I legami chimici: covalenti, ionici e metallici
I legami chimici costituiscono il fondamento stesso della chimica e della materia come la conosciamo. Questi legami invisibili, ma incredibilmente potenti, sono le forze che tengono uniti atomi e molecole, permettendo la formazione di sostanze con proprietà uniche e diverse.
Dall’acqua che beviamo alla struttura del DNA che codifica le informazioni genetiche di ogni essere vivente, i legami chimici giocano un ruolo cruciale in quasi ogni processo naturale e tecnologico.
In questo articolo, ci addentreremo nel mondo dei legami chimici, esplorando le loro tre diverse tipologie: covalenti, ionici o metallici.
I legami covalenti
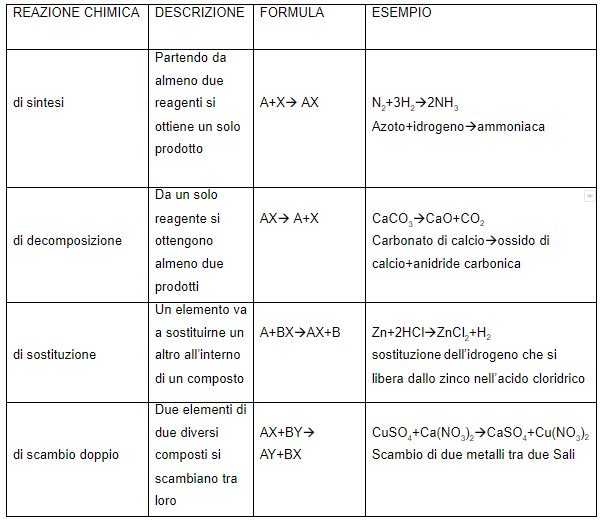
Il legame covalente si forma quando due atomi mettono in comune una coppia di elettroni.
Se i due atomi sono identici il legame è covalente puro, altrimenti, se hanno diversa elettronegatività è detto polare.
Nel caso in cui gli atomi formino un legame covalente polare si forma un dipolo, in cui gli elettroni sono più spostati verso l’atomo con maggiore elettronegatività.
Ad esempio, il metano CH4 è un legame covalente puro con differenze di elettronegatività di 0,4. La molecola di acqua H2O, invece, è formata da due legami covalenti polari tra l’ossigeno e due atomi di idrogeno che hanno differenza di elettronegatività elevata (3,5-2,1=1,4).
Il legame covalente può essere:
- singolo: se è condivisa una sola coppia di elettroni;
- doppio: se sono condivise due coppie di elettroni;
- triplo: se sono condivise tre coppie di elettroni.
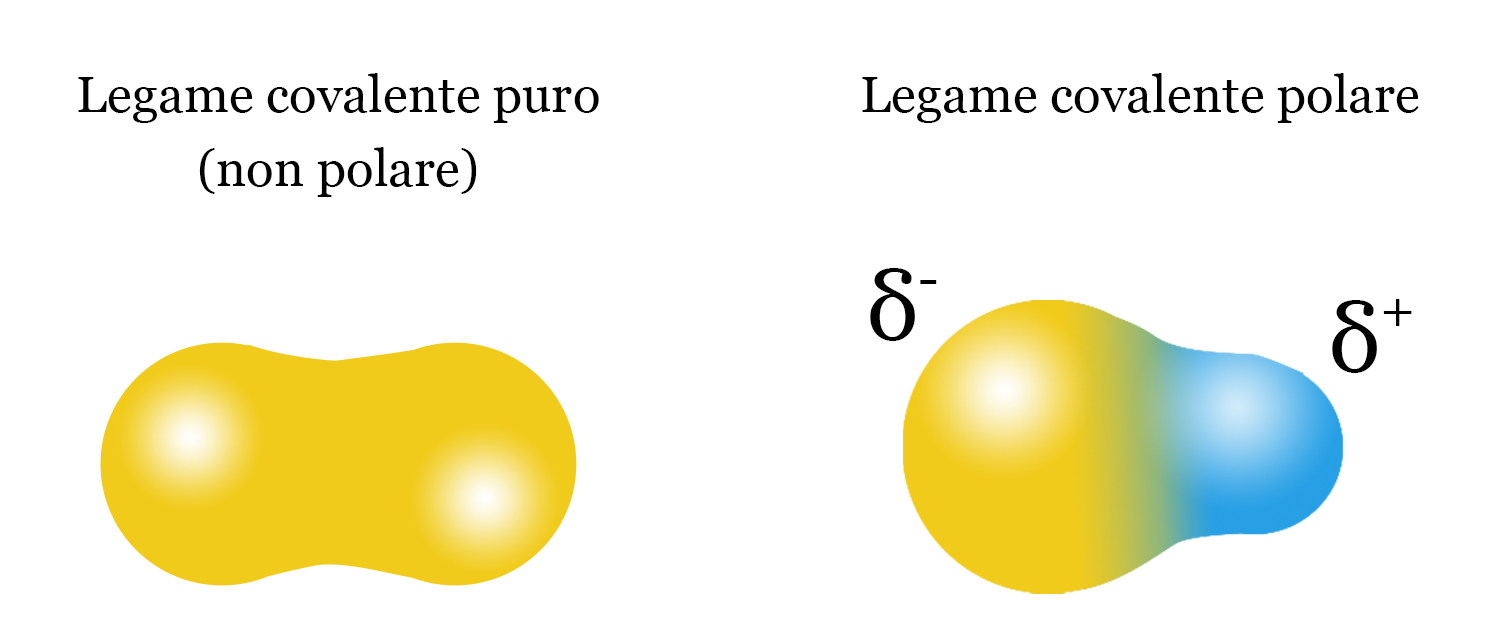
Un esempio: il metano
Il metano CH4 è un legame covalente puro con differenze di elettronegatività di 0,4.
I legami ionici
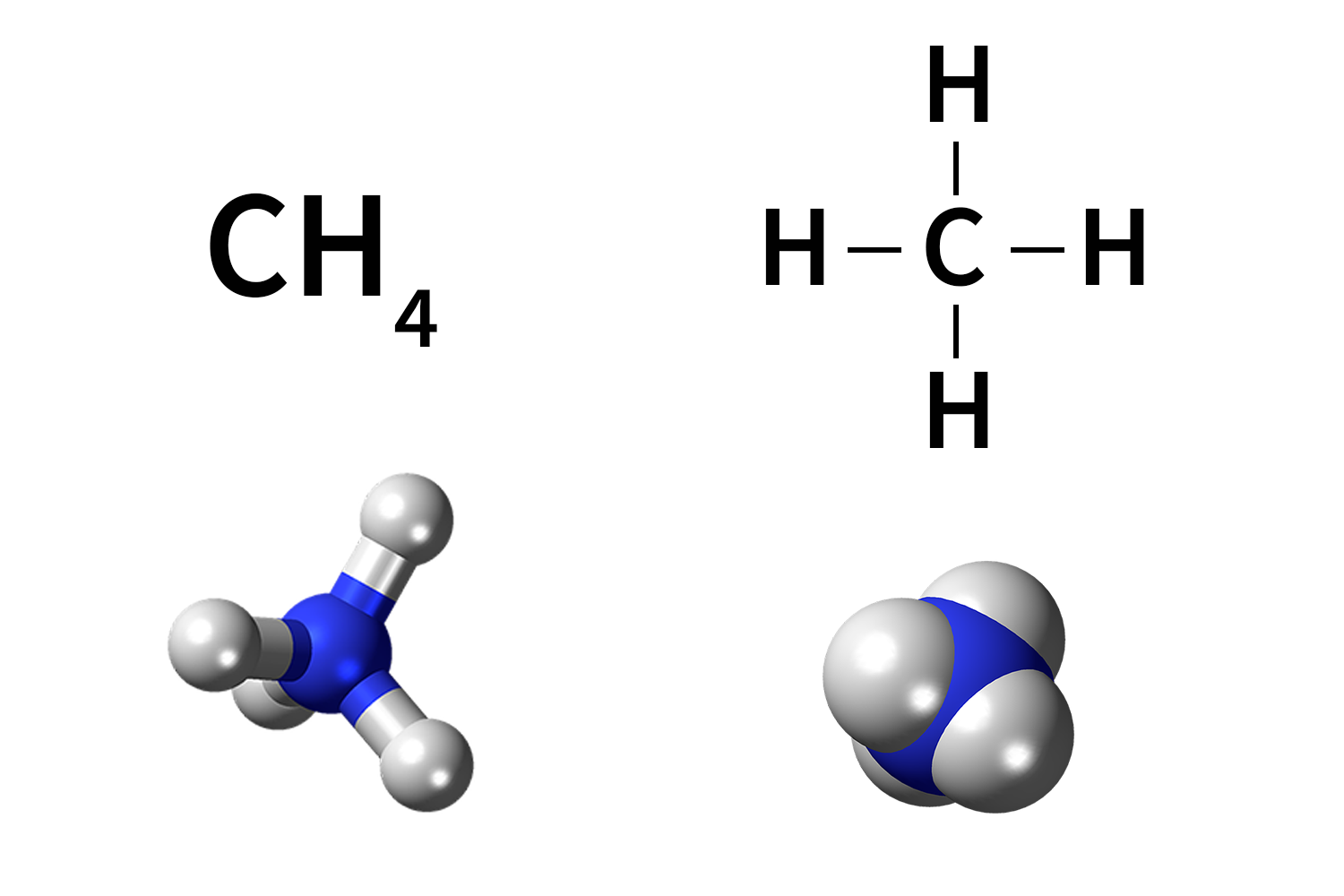
L’atomo dà origine agli ioni cedendo o acquistando uno o più elettroni: i cationi sono ioni positivi ottenuti per cessione di elettroni, mentre gli anioni sono ioni negativi ottenuti per acquisizione di elettroni.
Il legame ionico si ottiene quando la differenza di elettronegatività tra gli atomi è molto alta.
Una volta formatosi, l’anione assume la configurazione del gas nobile successivo, mentre il catione assume quella del gas nobile che lo precede nella tavola periodica.
Nei composti ionici gli ioni formano un reticolo cristallino disponendosi con una geometria regolare occupando posizioni fisse.
Ad esempio, il calcio (Ca) e il fluoro (F) hanno elettronegatività pari a 1,0 e 4,0 quindi una differenza di elettronegatività di 3,0. Il fluoro completerà il suo livello più esterno strappando un elettrone al calcio e in questo modo si formerà il fluoruro di calcio (CaF2). Per ogni ione Ca2+ saranno presenti due ioni F- in rapporto 2 a 1.
I legami metallici
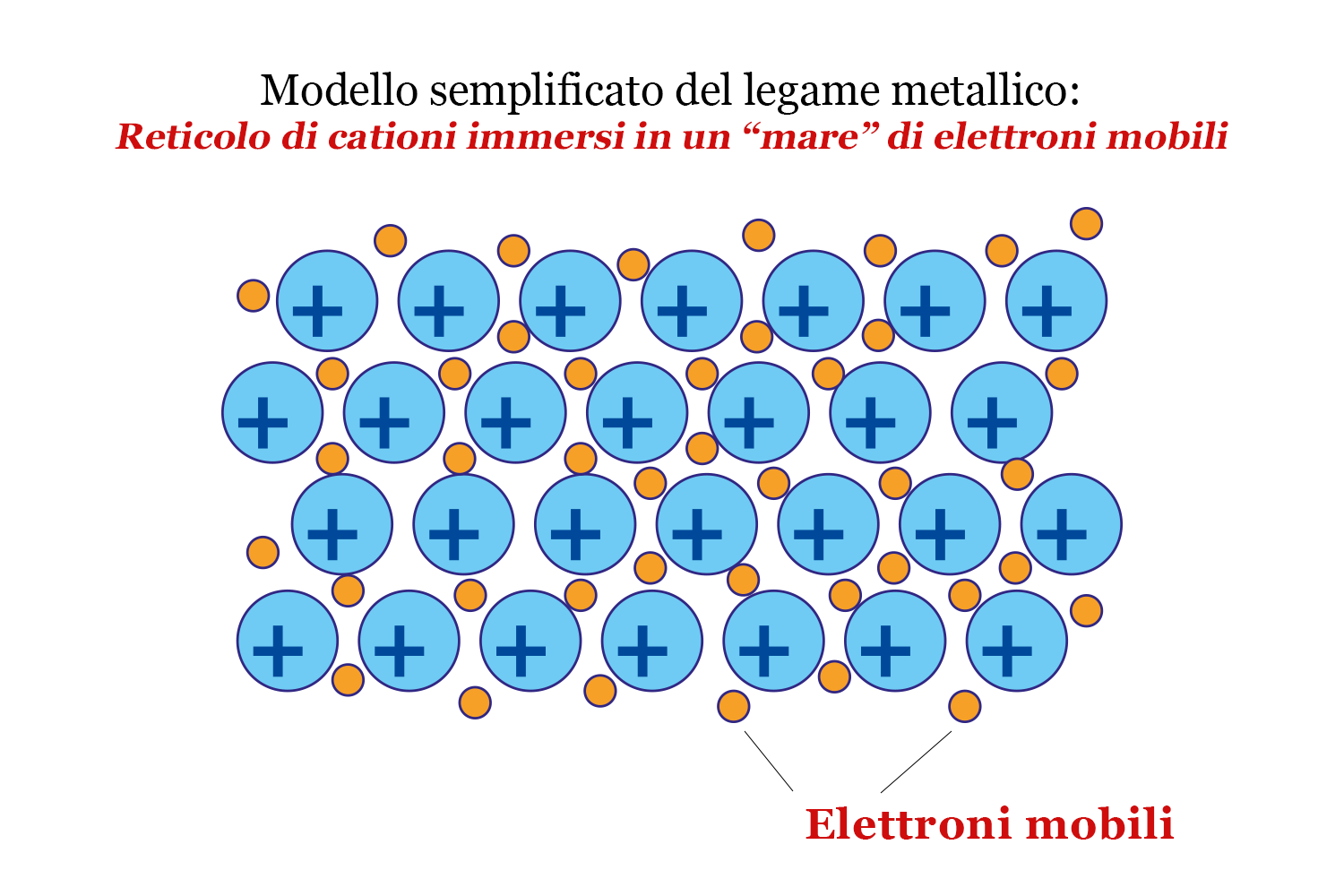
Il legame metallico avviene solo tra metalli ed è dovuto all’attrazione fra gli ioni metallici positivi e gli elettroni mobili che li circondano.
Tanto più forte è il legame metallico, tanto più sono numerosi gli elettroni mobili.
Nel legame metallico gli elettroni non hanno posizioni fisse e non appartengono più ai singoli atomi: questo è il motivo per cui i metalli sono caratterizzati da deformabilità e conducibilità elettrica e termica.
Rapporto tra reazioni chimiche e legami
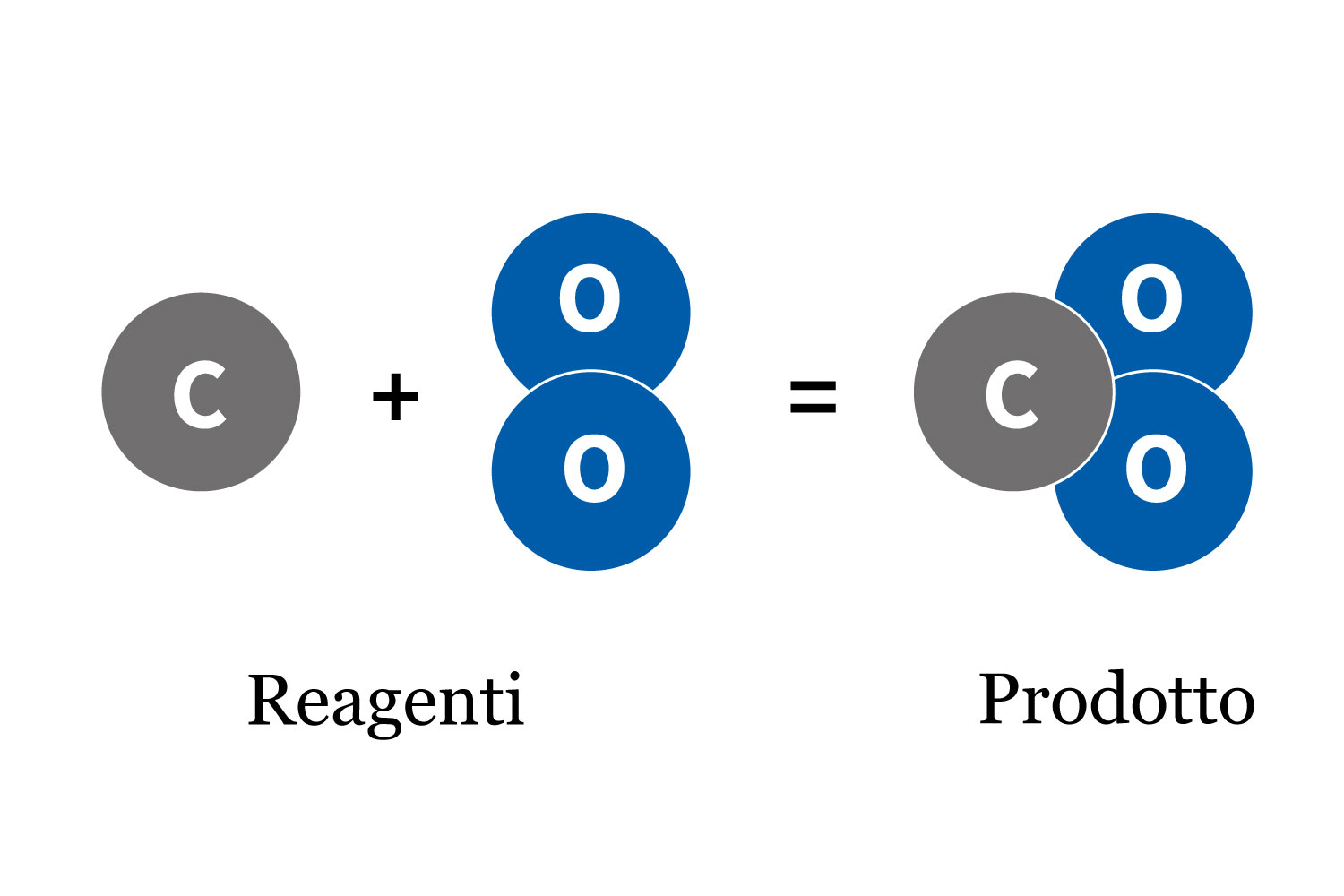
Le reazioni chimiche sono intrinsecamente legate ai legami chimici, poiché ogni reazione comporta la rottura di legami preesistenti e la formazione di nuovi legami tra atomi. Questo processo di riorganizzazione atomica trasforma i reagenti (la sostanza di partenza) in prodotti (la sostanza ottenuta in seguito ai legami chimici), ciascuno con proprietà chimiche e fisiche distinte.
Quando avviene una reazione chimica, i legami nei reagenti vengono rotti mediante l’assorbimento di energia, come il calore, la luce o l’elettricità. Gli atomi o i gruppi di atomi vengono quindi riarrangiati in nuovi modelli, formando nuovi legami e rilasciando o assorbendo ulteriore energia nel processo. La natura di questi legami – siano essi ionici, covalenti, metallici o altri tipi di interazioni più deboli – determina la stabilità e le proprietà dei composti formati.
La massa dei prodotti è sempre uguale alla massa dei reagenti. Infatti la sostanza in eccesso, che non segue le proporzioni definite, non partecipa alla reazione e rimane invariata.
- Molte reazioni chimiche avvengono spontaneamente mettendo a contatto i reagenti (come ad esempio bicarbonato di sodio e aceto che, se uniti, formano una schiuma).
- Altre reazioni chimiche, invece, hanno bisogno di essere innescate (come ad esempio, zucchero e ossigeno: sono sempre in contatto ma se avviciniamo una fiamma inizia la reazione chimica che porta alla formazione di carbonio, acqua e gas).

Esistono sostanze, dette catalizzatori, che stimolano le reazioni chimiche senza subire cambiamenti. I catalizzatori positivi aumentano la velocità di reazione mentre quelli negativi la diminuiscono.
Le reazioni chimiche possono essere esotermiche (quando liberano calore) oppure endotermiche (quando assorbono calore).
Schema riassuntivo delle reazioni chimiche