La tavola periodica degli elementi: come si legge
La tavola periodica degli elementi è una pietra miliare nella scienza moderna, che organizza tutti gli elementi chimici conosciuti in base alle loro proprietà atomiche in un sistema coerente e prevedibile.
Questo importantissimo strumento ha fornito un quadro organizzativo per gli elementi esistenti, ma ha anche aperto la strada a future scoperte, facilitando lo studio e l’applicazione della chimica in vari campi, dalla fisica alla biologia, dalla medicina alla tecnologia.
La sua importanza risiede nella capacità di sintetizzare vasti insiemi di informazioni chimiche in un formato comprensibile e di prevedere le proprietà degli elementi, rendendola uno strumento indispensabile per gli scienziati di tutto il mondo.
- Che cos'è la tavola periodica degli elementi
- Come si legge la tavola periodica
- Gli otto gruppi della tavola periodica
- Gli elementi: metalli, non metalli e semimetalli
- Configurazione elettronica e elettronegatività nella tavola degli elementi
Che cos’è la tavola periodica degli elementi
La tavola periodica fu creata nel 1869 dal chimico russo Dmitrij Mendeleev (1834-1907) che decise di disporre gli elementi secondo un ordine ben preciso.
Gli elementi che conosciamo oggi sono 118, ma a quel tempo Mendeleev ne conosceva solo 63. La sua lungimiranza lo portò a lasciare degli spazi vuoti nella tavola degli elementi per fare in modo che venisse riempita nel tempo in seguito a nuove scoperte.
Mendeleev ordinò gli elementi secondo il peso atomico crescente (dal più piccolo al più grande), ma successivamente questi vennero ordinati secondo il numero atomico (ovvero secondo il numero di protoni presenti nel nucleo).
Caratteristica principale è la periodica distribuzione degli elettroni nel livello più esterno: questo significa che gli elementi della stessa colonna hanno configurazione elettronica esterna simile e di conseguenza simili proprietà chimiche e fisiche.
Come si legge la tavola periodica
Oggi la tavola periodica è divisa in 7 righe (i periodi) e 18 colonne (i gruppi).
I periodi sono numerati da 1 a 7 e gli elementi della stessa riga hanno gli elettroni più esterni allo stesso livello di energia. I gruppi invece hanno numerazione doppia: i numeri arabi da 1 a 18 e i numeri romani da I a VIII che indicano il numero di elettroni nell’ultimo livello di energia.
Troviamo infine due righe separate dal resto della tavola periodica in cui sono compresi i lantanoidi (con numero atomico compreso tra 57 e 71) e gli attinoidi (con numero atomico compreso tra 89 e 103).
In ogni casella della tavola periodica troviamo il simbolo chimico dell’elemento, il nome, il numero atomico e il peso atomico. Ad esempio: l’Idrogeno con simbolo H, numero atomico 1 e peso atomico 1,00794.

Gli otto gruppi della tavola periodica
Abbiamo visto che i gruppi principali della tavola periodica sono otto e sono così suddivisi:
- GRUPPO I sono i metalli alcalini dal litio (Li) al francio (Fr) e formano con l’ossigeno composti facilmente solubili in acqua. Ricordiamo di questo gruppo il sodio (Na) e il potassio (K);
- GRUPPO II sono i metalli alcalino-terrosi dal berillio (Be) al radio (Ra) e formano gli ossidi con l’ossigeno. Ricordiamo di questo gruppo il calcio (Ca) e il magnesio (Mg);
- GRUPPO III sono gli elementi che non si trovano in natura allo stato puro, ma solo come composti. Ricordiamo il boro (B) e l’alluminio (Al);
- GRUPPO IV ricordiamo il carbonio (C ), il silicio (Si), lo stagno (Sn) e il piombo (Pb);
- GRUPPO V ricordiamo azoto (N) e fosforo (P);
- GRUPPO VI formano i minerali. Ricordiamo ossigeno (O) e zolfo (S);
- GRUPPO VII gli alogeni ovvero generatori di Sali. Gli elementi principali di questo gruppo sono fluoro (F), cloro (Cl), bromo (Br) e lo iodio (I);
- GRUPPO VIII i gas nobili. Esistono solo in forma monoatomica e a temperatura ambiente sono incolori e inodori.
Gli elementi: metalli, non metalli e semimetalli
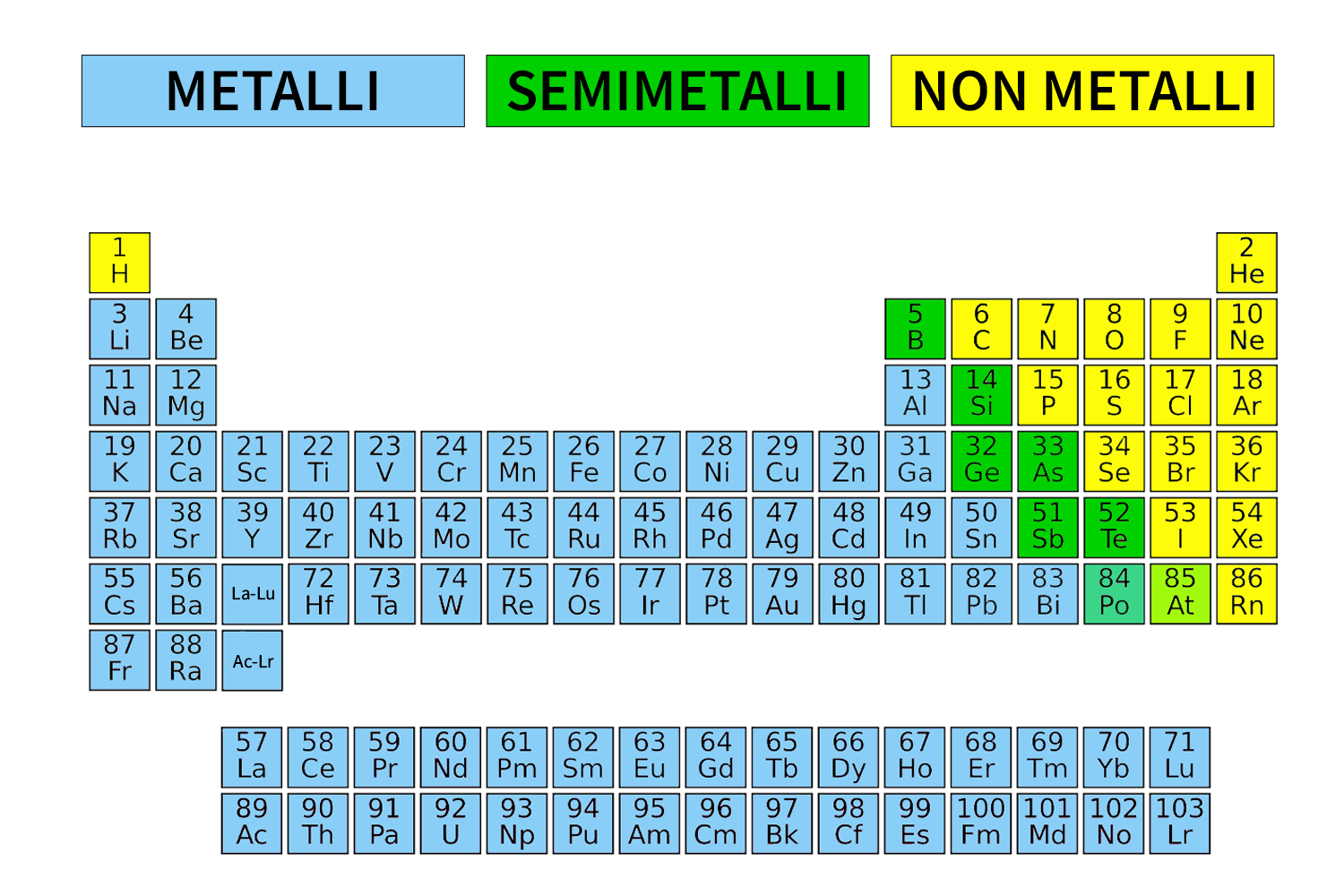
La tavola periodica classifica inoltre gli elementi in metalli, semimetalli e non metalli. La maggior parte degli elementi appartiene alla categoria dei metalli: i più noti sono oro, argento, rame, ferro, alluminio e titanio. Le caratteristiche principali dei metalli sono:
- sono solidi a temperatura ambiente (tranne il mercurio (Hg) che è liquido);
- hanno buona conducibilità elettrica e termica, aspetto metallico e lucente, duttilità, malleabilità, punto di fusione elevato e densità elevata;
- cedono facilmente uno o più elettroni;
- si legano con altri atomi dello stesso metallo.
I non metalli sono posizionati a destra della tavola periodica e hanno comportamento opposto rispetto ai metalli:
- possono essere solidi, liquidi o gassosi;
- sono cattivi conduttori di elettricità e calore;
- non sono duttili e malleabili;
- sono opachi.
I semimetalli hanno caratteristiche intermedie fra i metalli e i non metalli. Sono detti anche semiconduttori. I più noti sono il silicio (Si) e il germanio (Ge) che sono utilizzati nel campo dell’elettronica.
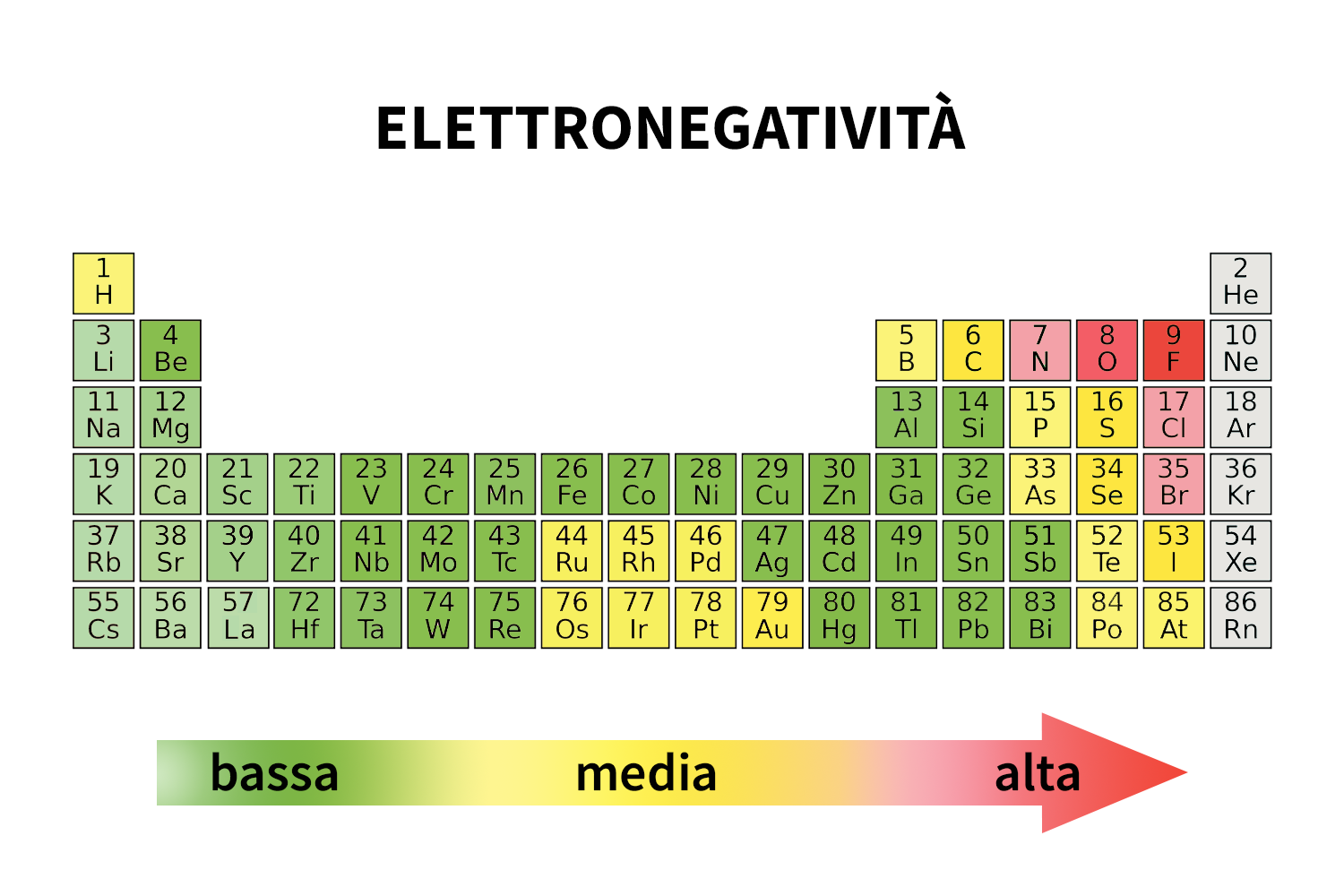
Configurazione elettronica e elettronegatività nella tavola degli elementi
Abbiamo visto che un atomo è formato da neutroni e protoni che stanno nel nucleo e da elettroni che ruotano attorno al nucleo. La capacità di un atomo di legarsi o staccarsi da un altro atomo dipende dagli elettroni più distanti dal nucleo.
A tal riguardo, la configurazione elettronica e l’elettronegatività sono due concetti chiave nella tavola periodica degli elementi che giocano un ruolo fondamentale nella determinazione delle proprietà chimiche degli elementi.
- La configurazione elettronica descrive la distribuzione degli elettroni negli orbitali atomici di un elemento e segue un modello prevedibile all’interno della tavola periodica. Essa viene appresentata proprio dalla disposizione degli elettroni sui livelli di energia (da 1 a 7 nella tavola periodica) e sugli orbitali (indicati con le lettere s, p, d, f). Man mano che ci si sposta da sinistra a destra lungo un periodo, gli elettroni si aggiungono ai medesimi livelli energetici, modificando le proprietà degli elementi.
- L’elettronegatività, d’altra parte, misura la tendenza di un atomo a attrarre gli elettroni verso di sé quando forma un legame chimico. Nella tavola periodica questa capacità aumenta da sinistra verso destra lungo i periodi e diminuisce dall’alto verso il basso lungo i gruppi. Il fluoro (F) è l’elemento con maggiore elettronegatività mentre il francio (Fr) è quello meno elettronegativo.
Gli elementi meno stabili, ovvero quelli più reattivi, tendono a combinarsi tra loro alla ricerca degli elementi che completino il livello energetico più esterno che per essere completo ha bisogno di otto elettroni, per questo si dice “regola dell’ottetto elettronico”.
Nella tavola periodica, passando dal primo all’ottavo gruppo il livello energetico più esterno si arricchisce di elettroni fino a completarsi con otto elettroni.
Gli elementi dell’ottavo gruppo saranno quelli più stabili e meno reattivi e sono detti gas nobili o inerti. Da notare che l’elio (He) è l’unico gas nobile stabile con soli due elettroni all’orbitale più esterno.
