Legge di Boyle: esperimento ed enunciato
La natura dei gas e la loro reattività alle variazioni di pressione e volume hanno sempre intrigato la mente degli scienziati. Mentre sperimentavano con queste particolari forme di materia, cercando di comprendere le leggi che governano il loro comportamento, emerse una relazione fondamentale, formulata da un fisico e chimico irlandese nel XVII secolo. Quest’uomo era Robert Boyle, e la sua scoperta, nota come “legge di Boyle“, rappresenta una delle pietre miliari nella storia della chimica e della fisica dei gas.
Questa legge, apparentemente semplice nella sua formulazione, ha implicazioni profonde e ha gettato le basi per ulteriori studi nel campo della termodinamica e della meccanica dei fluidi. Scopriamo insieme tutto quello che c’è da sapere su questa legge!
- Enunciato della legge di Boyle
- Formulazione matematica della legge di Boyle
- Trasformazione fisica e legge di Boyle
- Legge di Boyle: un esperimento
Enunciato della legge di Boyle

La legge di Boyle descrive una trasformazione isoterma lungo cui, mantenendo la temperatura costante, un gas può variare la sua pressione ed il suo volume. Se rappresentiamo tale trasformazione in un grafico in cui poniamo la pressione sull’asse delle ordinate ed il volume su quello delle ascisse, otterremo un ramo di iperbole.
Se il gas è portato ad accrescere il suo volume, la sua pressione starà automaticamente diminuendo, muovendosi a temperatura costante lungo la curva rappresentata. Allo stesso modo, ad una diminuzione di volume corrisponderà un aumento della pressione del gas, il quale si starà muovendo da destra verso sinistra lungo il ramo d’iperbole mostrato.
In definitiva:
Se la temperatura di un gas perfetto è costante, il suo volume e la sua pressione risultano essere inversamente proporzionali.
Formulazione matematica della legge di Boyle
La legge di Boyle descrive una trasformazione a temperatura costante. A partire dall’equazione di stato dei gas perfetti si può dunque giungere alla formulazione della legge grazie ad alcuni passaggi:
£$pV = nRT$£
La costante dei gas £$R$£ è un valore numerico che non varia mai. In quanto tale, può quindi essere considerato una costante:
£$pV = n \ cost \ T$£
Nelle trasformazioni di un gas che non comportano aggiunta o sottrazione di massa, anche il numero di moli può essere considerato costante e quindi inglobato nel termine più generico £$cost$£:
£$pV = cost \ T$£
Da ultimo, è possibile inglobare anche la temperatura nel termine generico £$cost$£. Come già anticipato infatti, la legge di Boyle è una semplificazione dell’equazione di stato dei gas perfetti, scritta nel caso particolare in cui la temperatura sia costante.
£$pV = cost \ T$£
La precedente formulazione rappresenta la legge di Boyle.
Trasformazione fisica e legge di Boyle
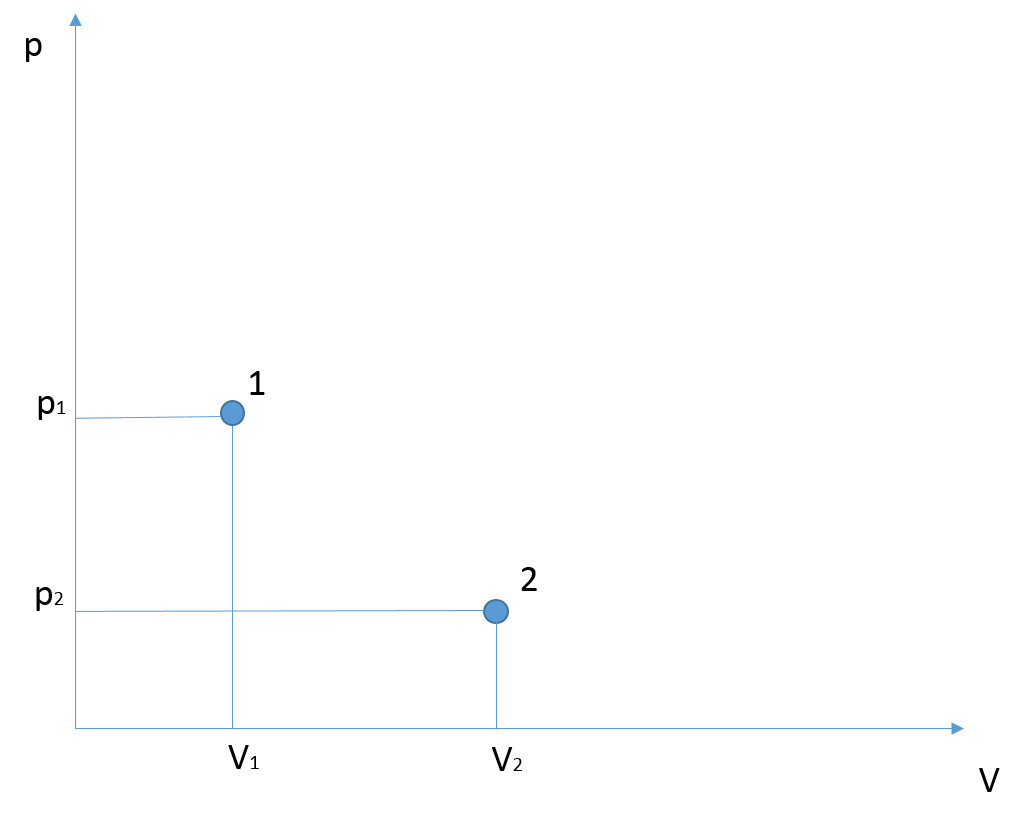
La legge di Boyle descrive una trasformazione a temperatura costante. Considerato un generico gas che si trova in una determinata condizione fisica £$1$£, è possibile descrivere una trasformazione a temperatura costante che lo porterà alla condizione fisica £$2$£ muovendosi lungo un’iperbole rappresentata nel piano £$p-V$£, come già anticipato. La formulazione generale della legge di Boyle può essere riscritta specificando se ci si riferisce allo stato iniziale oppure a quello finale:
£$p_{1}V_{1} = cost$£ £$p_{2}V_{2} = cost$£
Il termine a destra delle uguaglianze esprime una costante, la stessa per entrambe le equazioni. In conclusione è possibile affermare che i due termini a sinistra siano uguali:
£$p_{1}V_{1} = p_{2}V_{2}$£
Come conseguenza, note le quantità fisiche di un determinato stato ed una sola quantità tra pressione e volume relativa al secondo stato, sarà possibile calcolarsi la quantità mancante di quest’ultimo.
Legge di Boyle: un esperimento
Ti è mai successo di accorgerti che le tue orecchie si stappino o tappino quando stai salendo o scendendo da una montagna procedendo abbastanza velocemente in auto? Bene, questo è un effetto della legge di Boyle. Quello che sta succedendo infatti è che le tue orecchie si trovano sottoposte ad una pressione minore salendo di quota, e l’aria contenuta all’interno, che può essere considerata come un gas ideale, si trova alla pressione che si aveva a bassa quota. La camera d’aria presente è quindi portata a variare la sua pressione ed il suo volume, a temperatura costante.
Per capire al meglio l’effetto di questa trasformazione immaginiamo di fare il seguente esempio: portiamo con noi un palloncino salendo in quota. Quello che osserveremmo è che il palloncino aumenterebbe di dimensione man mano che si procede verso l’alto. Come ci giustifichiamo questo fenomeno? Vediamo insieme una semplice spiegazione: un normale palloncino gonfiato a terra possiede al suo interno una certa quantità di gas ideale (l’aria) che si trova a pressione atmosferica e che occupa un certo volume. Quando lo stesso palloncino viene portato in quota, la pressione esterna risulterà essere più bassa poiché la colonna d’aria si riduce e la pressione atmosferica è minore man mano che si procede in altezza. Come conseguenza di ciò, il volume di aria contenuta all’interno del palloncino tenderà ad aumentare.Volumi sempre maggiori verranno raggiunti man mano che si procede in quota, in accordo con la legge di Boyle per cui volume e pressione risultano inversamente proporzionali, a temperatura costante:
£$pV = cost$£
