Il calore e la temperatura: qual è la differenza
Molto spesso, nel linguaggio di tutti i giorni, usiamo le parole calore e temperatura quasi con lo stesso significato, mentre invece c’è una differenza tra questi due elementi. Infatti:
- il calore è una forma di energia;
- la temperatura è una proprietà che aiuta a misurare la quantità di calore presente all’interno di un corpo o di una sostanza.
In questo articolo capiremo meglio cosa sono il calore e la temperatura e come si possono definire!
- Cos'è la termodinamica
- Cosa sono il calore e la temperatura
- Il calore e il suo trasferimento
- Il calore specifico
- Il calore latente
- La definizione di temperatura
- Storia della temperatura
- La dilatazione termica
- Le dilatazioni volumetrica, superficiale e lineare
Cos’è la termodinamica
La termodinamica è una branca della fisica che studia i processi riguardanti la trasformazione di massa ed energia e tutto ciò che è inerente con il calore. In particolare, la termodinamica studia gli scambi di energia tra il sistema e l’ambiente che possono verificarsi durante una trasformazione, sia essa fisica o chimica, con l’obiettivo di individuare le condizioni di equilibrio o di evoluzione dello stesso sistema.
Un sistema termodinamico è in equilibrio quando le sue caratteristiche, come la temperatura, la pressione e il volume, restano costanti nel tempo. Se non è in equilibrio, invece, il sistema tenderà ad evolvere in autonomia per cercare di raggiungere una condizione di equilibrio.
Cosa sono il calore e la temperatura
Il calore può essere definito come energia termica, trasferita tra due corpi che si trovano ad una temperatura differente. Proprio per questo, il calore è una tipologia di energia definita di transito, proprio perché si trasferisce da un corpo all’altro.
In particolare, un corpo che ha una temperatura più alta può trasferire calore ad un altro corpo con temperatura più bassa, ma non può accadere il contrario: un corpo a temperatura bassa non potrà trasferire calore ad un corpo a temperatura ancora più alta.
Il calore, essendo una forma di energia, ha una sua unità di misura, il joule £$(J)$£ anche se spesso si fa riferimento, in chimica, alle calorie (cal). Una caloria, infatti, è la quantità di calore necessaria per alzare la temperatura di un grammo di acqua distillata da 14,5°C a 15,5°C, alla pressione di 1 atmosfera.
La temperatura, invece, è una proprietà che ci indica lo stato termico di un corpo, cioè lo stato di agitazione delle molecole di cui il corpo è formato. Quando il calore viene trasferito, infatti, le molecole che compongono il corpo cominciano a muoversi più velocemente. Questo fenomeno dà origine all’energia cinetica, cioè l’energia del movimento.
Proprio per questo, possiamo definire la temperatura come la misura dell’energia cinetica delle particelle che costituiscono un corpo. L’unità di misura della temperatura è il kelvin £$(K)$£ e fa riferimento alla scala assoluta della temperatura. Infatti, tutti noi tendiamo ad utilizzare come unità di misura il grado Celsius £$(°C)$£.
Il calore e il suo trasferimento
Il calore viene definito come il contributo di energia trasformata a seguito di una reazione chimica o nucleare e trasferita tra due elementi, non dovuta ad un lavoro.
Il calore quindi è una forma di energia trasferita e non una forma di energia contenuta.
Esso al pari di tutte le altre forme di energia si misura in J (ricordiamo che £$1 J = 1 N \cdot m = 1 \frac {kg \cdot m^2}{s^2}$£ )
Solamente nel XIX secolo si iniziò a parlare della termodinamica, grazie agli studi di Mayer (1842) e Joule (1843), riguardanti la quantità di calore e il lavoro necessario per ottenerlo.
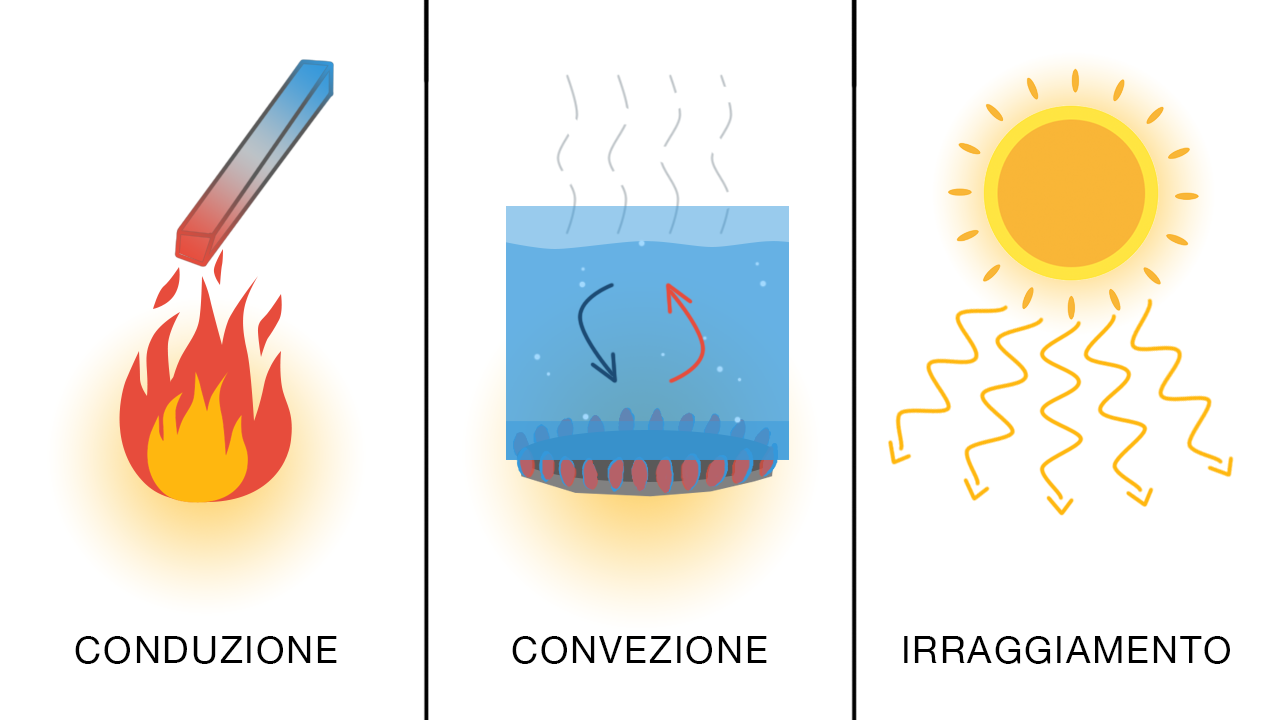
Il calore può trasferirsi tra gli oggetti in tre modi:
- Per conduzione: in uno stesso corpo o fra corpi a contatto si ha una trasmissione, per urti, di energia cinetica tra le molecole. Nella conduzione viene trasferita energia attraverso la materia, ma senza spostamento di materia;
- Per convezione: è dovuta alla presenza di correnti nei fluidi; è assente nei solidi e trascurabile per i fluidi molto viscosi; viene causato da una pressione e dalla forza di gravità. È caratterizzato da moti di circolazione interni al fluido. Nella convezione viene trasferita energia con trasporto di materia;
- Per irraggiamento: tra due corpi (anche trasparenti) la trasmissione di calore può avvenire a distanza (anche nel vuoto). Anche in questo caso il corpo a temperatura inferiore si riscalda e quello a temperatura superiore si raffredda. Il meccanismo dell’irraggiamento non richiede il contatto fisico tra i corpi coinvolti nel processo.
Esempio.
Per conduzione: se una fiamma scalda una barra di metallo, a poco a poco tutta la barra si scalda.
Per convezione: una pentola piena d’acqua si scalda a partire dal basso .
Per irraggiamento: il calore del sole arriva sulla Terra dopo aver viaggiato per 150 milioni di km attraverso il vuoto.
Il calore specifico
La capacità termica di un corpo è direttamente proporzionale alla sua massa.
£$C=cm$£
£$C$£ è la capacità termica e si misura in £$ \frac JK$£
£$c$£ è il calore specifico e si misura in £$\frac {J}{kg\cdot K}$£
£$m$£ è la massa e si misura in kg.
Il calore specifico di una sostanza è uguale alla quantità di energia necessaria per innalzare di 1 K la temperatura di 1 Kg di quella sostanza.
Proprio da questo deriva la formula:
£$ \Delta Q = c \cdot m \cdot \Delta T $£
Essa definisce la quantità di calore Q scambiata (quindi ceduta o acquistata) a seconda della variazione di temperatura £$ \Delta T $£ . In particolare tra £$ \Delta Q$£ e £$ \Delta T $£ vi è un rapporto di proporzionalità diretta. Inoltre, se la variazione di temperatura è positiva (ovvero il corpo si riscalda), anche la variazione di quantità di calore ha segno positivo, mentre se il corpo si raffredda, £$ \Delta Q$£ e £$ \Delta T $£ sono entrambi negativi.
Una grandezza analoga è il calore specifico molare. Quest’ultimo si differfenzia dal calore specifico per il fatto che prende in considerazione un’unità di mole.
Nel Sistema internazionale l’unità di misura:
- del calore specifico è il £$\frac {\text{J}}{\text{K}\cdot \text{kg}}$£ , si usa anche il £$ \frac{\text{kcal}}{\text{kg} \cdot °\text{C}}$£
- del calore molare è il £$\tfrac {\text{J}}{\text{K}\cdot \text{mol}}$£.
Il calore latente
Il calore latente è la quantità di energia scambiata da un sistema di una certa massa, sotto forma di calore, durante un passaggio di stato.
Esistono tre tipi di calore latente, a seconda del passaggio di stato in questione:
- Calore latente di fusione
- Calore latente di vaporizzazione
- Calore latente di sublimazione.
Il calore latente £$L$£ è legato al calore scambiato £$Q$£ e alla massa £$m$£ del sistema dalla formula
£$Q=Lm$£
L’unità di misura del calore latente è quindi £$\frac {J}{kg}$£
La definizione di temperatura
La temperatura viene definita come una misura dello stato di agitazione delle molecole di un corpo e si misura attraverso il termometro.
Essa è inoltre definibile per mezzo di una grandezza fisica scalare (ovvero non dotata di direzione e verso), che indica lo stato termico di un corpo.
Nel Sistema Internazionale la temperatura è una delle sette grandezze fondamentali e viene misurata in Kelvin (si ricorda che 0 K = -273,15°C).
Può essere utilizzata per prevedere la direzione verso la quale avviene lo scambio termico tra più corpi. Infatti la differenza di temperatura tra questi, determina un flusso di calore in direzione del sistema meno caldo, che continua finché non viene raggiunto l’equilibrio termico, in cui i due sistemi hanno la stessa temperatura.
Storia della temperatura
Il concetto di temperatura nasce come tentativo di quantificare le nozioni comuni di “caldo” e “freddo”.
In seguito la comprensione dei fenomeni termici estende il concetto di temperatura e mette in luce il fatto che le percezioni termiche sono il risultato di una complessa serie di fattori che includono la temperatura.
I primi tentativi di dare un numero alla sensazione di caldo o di freddo risalgono ai tempi di Galileo.
Il primo termometro ad alcool viene attribuito tradizionalmente all’inventiva del granduca di Toscana Ferdinando II de’ Medici. Ma si va affermando la convinzione che il termometro a liquido in capillare chiuso sia stato inventato da altri, molto prima.
Il termometro a mercurio viene attribuito a Gabriel Fahrenheit, che nel 1714 introdusse una scala di temperature ancora in uso.
La dilatazione termica
La dilatazione termica è un fenomeno fisico che si realizza quando un corpo aumenta di volume all’aumentare della temperatura. Tale aumento è causato dalla variazione dell’oscillazione degli atomi.
A livello macroscopico il materiale si dilata in risposta all’aumento di temperatura. Se l’andamento della dilatazione in funzione della variazione di temperatura è lineare, viene definito il coefficiente di dilatazione termica.
Nei corpi solidi, avvengono tre tipi di dilatazione:
- dilatazione volumica
- dilatazione superficiale
- dilatazione lineare.
Le dilatazioni volumetrica, superficiale e lineare
Se la temperatura di un solido o di un liquido passa da £$T_{1}$£ a £$T_2$£, il suo volume passa dal volume iniziale £$V_{1}$£ al volume finale £$V_2$£ in modo che la variazione del volume £$\Delta V$£ sia direttamente proporzionale al volume iniziale e alla variazione di temperatura £$\Delta T$£.
La legge che regola la dilatazione volumetrica è:
£${\displaystyle \Delta V=kV_{1}\Delta T}$£
dove la costante £$k$£ prende il nome di coefficiente di dilatazione cubica, che esprime l’aumento volumetrico di un corpo, avente un volume iniziale unitario di £$1\ \text{m}^3$£, quando la sua temperatura aumenta di 1 °C.
Il volume finale si trova aggiungendo al volume iniziale £$V_{1}$£ la sua variazione.
£$V= V_{1} + \Delta V= V_{1} + k V_{1}\Delta T$£ £$V= V_{1}(1 + k \Delta T)$£
Nella dilatazione superficiale, l’aumento della superficie £$\Delta S$£ è direttamente proporzionale alla superficie iniziale £$S_{1}$£ e all’incremento di temperatura £$\Delta T$£
£$\Delta S=\sigma S_{1}\Delta T$£
dove £$\sigma$£ è il coefficiente di dilatazione superficiale. La superficie finale si trova aggiungendo a quella iniziale £$S_{1}$£ la dilatazione avvenuta.
£$S=S_{1}+\Delta S=S_{1}+\sigma S_{1}\Delta T$£
£$S=S_{1}(1+\sigma \Delta T)$£
Nella dilatazione lineare, l’aumento della lunghezza del corpo £$\Delta l$£ è direttamente proporzionale alla lunghezza iniziale £$l_{1}$£ e alla variazione di temperatura £$\Delta T$£
£$\Delta l=\lambda \ l_{1}\Delta T$£
dove £$\lambda$£ è il coefficiente di dilatazione lineare (e si misura in £$K^{−1}$£).
La lunghezza finale si trova aggiungendo a quella iniziale £$l_{1}$£ la sua variazione.
£$l=l_{1}+\Delta l=l_{1}+\lambda \ l_{1}\Delta T$£
£$l=l_{1}(1+\lambda \Delta T)$£
