L’esperimento di Rutherford: riassunto e analisi
Il concetto di “atomo” affonda le sue radici nell’antichità greca, ma è stato solo nell’era moderna che abbiamo iniziato a svelare veramente la sua struttura complessa e misteriosa. Uno degli esperimenti più importanti in questo percorso di scoperta fu condotto da Ernest Rutherford, insieme ai suoi collaboratori Hans Geiger e Ernest Marsden, all’inizio del XX secolo. Questo esperimento non solo ribaltò le idee preesistenti sulla struttura atomica, ma gettò anche le basi per la nascita della teoria nucleare dell’atomo.
Prima dell’esperimento di Rutherford, Geiger e Marsden, l’atomo era generalmente concepito seguendo il “modello a budino di prugne” proposto da J.J. Thomson. Secondo questa visione, l’atomo era una sfera diffusa di carica positiva in cui gli elettroni erano immersi, simili a prugne in un budino. Tuttavia, l’esperimento di Rutherford avrebbe sfidato questo modello in maniera radicale, portando alla luce una struttura atomica ben diversa e molto più intrigante.
L’importanza di questo esperimento non può essere sottolineata abbastanza: ha rivelato che al centro dell’atomo si trova un nucleo piccolo ma massiccio, portatore di tutta la carica positiva e quasi tutta la massa dell’atomo. Gli elettroni, al contrario, orbitavano attorno a questo nucleo in spazi relativamente vasti. La rivelazione ha segnato la nascita di una nuova era nella fisica e ha aperto la porta a ulteriori ricerche e scoperte sul nucleo atomico e sulla natura della materia.
L’esperimento di Rutherford
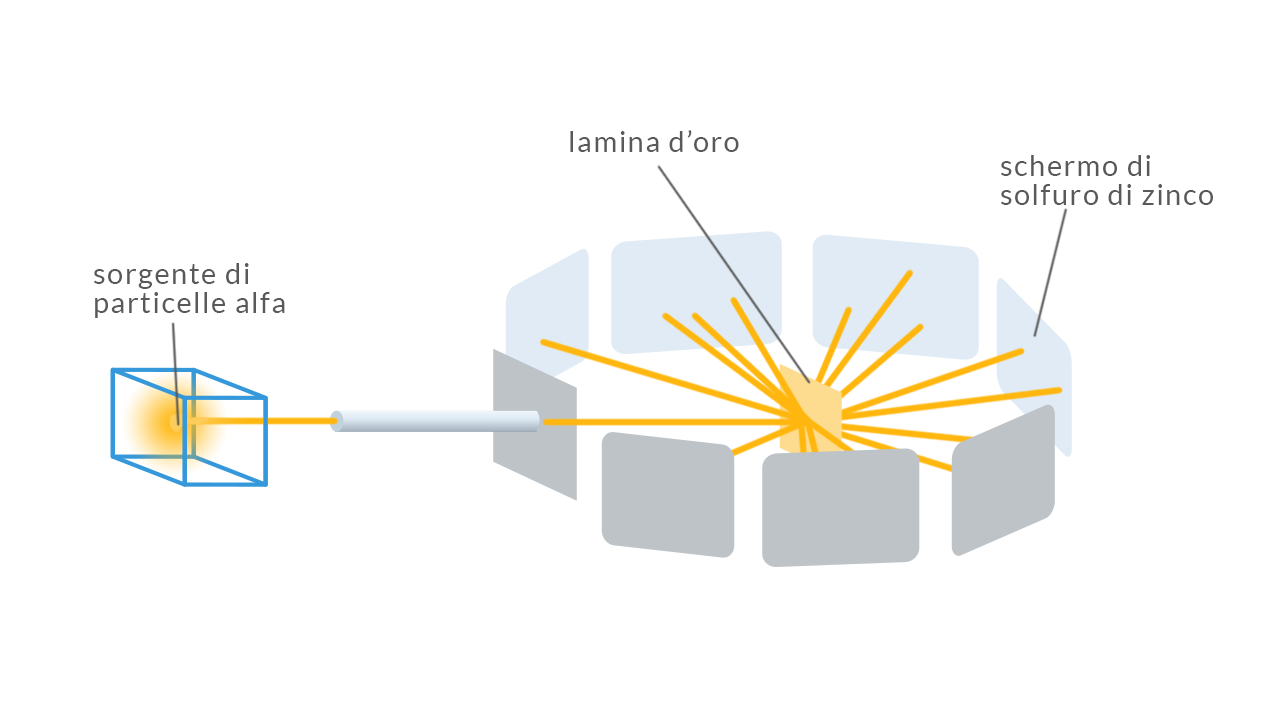
L’esperimento ideato e poi interpretato da Rutherford del 1911 consisteva in:
- una sorgente di particelle alfa, nuclei di elio formati da due protoni e due neutroni di massa 10 000 volte maggiore di quella dell’elettrone; sono emesse spontaneamente da materiali radioattivi
- una lamina d’oro molto sottile
- una serie di schermi di solfuro di zinco sensibili alle particelle alfa che circondano la lamina d’oro
L’esperimento consisteva nel dirigere un fascio di particelle alfa contro la lamina d’oro e rilevare, grazie agli schermi di solfuro di zinco, il loro angolo di deviazione rispetto al fascio incidente. Questi angoli di diffusione permettevano di avere informazioni sulla struttura atomica dei bersagli contro cui le particelle urtavano, in questo caso gli atomi della lamina d’oro.
Rutherford si aspettava delle evidenze sperimentali che fossero in accordo con il modello di Thomson, cioè che i fasci di particelle alfa attraversassero la lamina d’oro con angoli di deviazioni molto piccoli dato che:
- gli elettroni non danno un contributo massivo sufficiente all’atomo per deviare le particelle alfa così pesanti
- le particelle alfa risentono solo della repulsione dovuta alla sfera di carica positiva, subendo piccole deviazioni
I risultati dell’esperimento lasciarono Rutherford molto sorpreso.
La scoperta di Rutherford nel suo esperimento
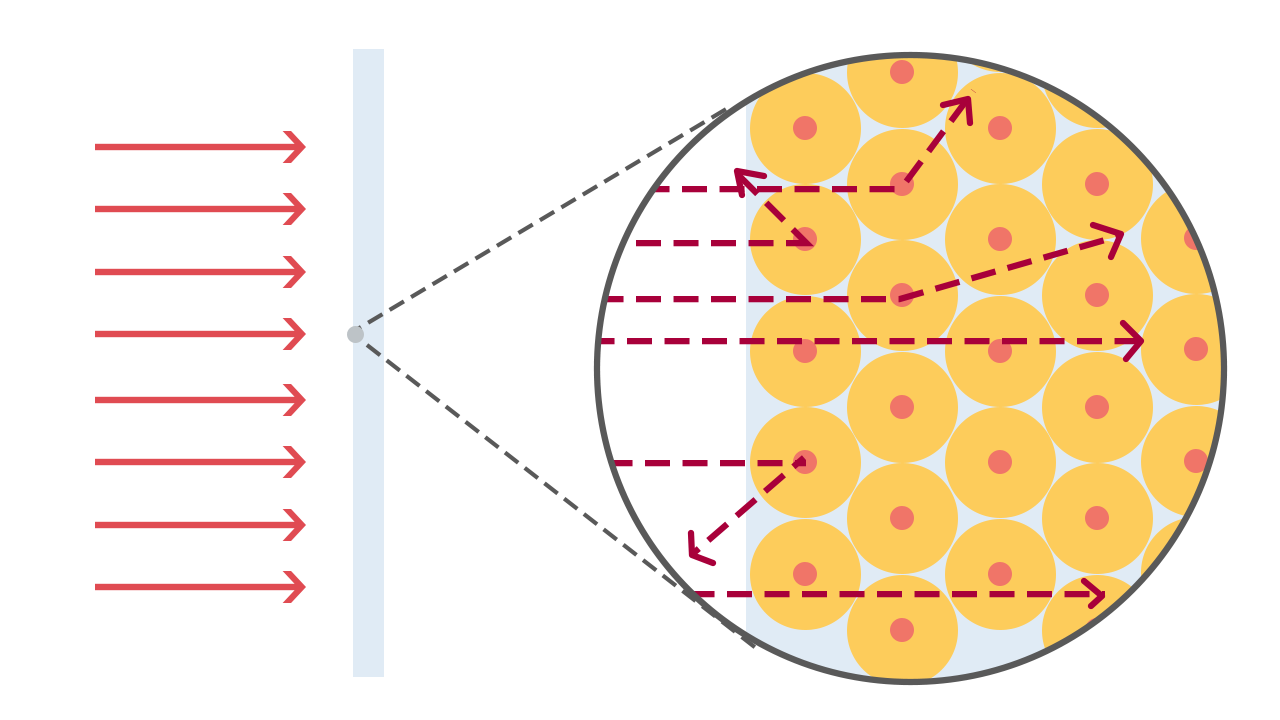
Rutherford, commentando i risultati del suo esperimento, dichiarò: “era quasi altrettanto incredibile che vedersi rimbalzare addosso un proiettile di artiglieria dopo averlo sparato contro un foglio di carta velina”.
Le evidenze sperimentali rivelarono che, non solo molte particelle venivano deviate di angoli significativi, ma una particella alfa su 8000 veniva addirittura riflessa dalla lamina d’oro, tornando indietro!
Il modello di Thomson si era rivelato inattendibile e non veritiero perché non giustificava in alcun modo il comportamento delle particelle alfa.
Rutherford, interpretando i suoi risultati, propose un nuovo modello atomico nel 1911 secondo cui l’atomo era costituito da un nucleo compatto di carica positiva posto al centro di una sfera molto più grande nella quale si muovevano gli elettroni. Il modello proposto non collocava precisamente gli elettroni nella sfera circostante al nucleo, fu dedotto intuitivamente che essi dovessero muoversi di moto rotatorio per bilanciare la carica atomica e non collassare verso il nucleo.
Il modello atomico di Rutherford prevedeva che il nucleo e gli elettroni in moto fossero legati dalla forza di Coulomb(LINK). Il nucleo ha un raggio dell’ordine di £$10^{-14} \ m$£ mentre gli elettroni vi orbitano attorno entro un raggio di £$10^{-10} \ m$£.
