Il primo principio della termodinamica e le sue applicazioni
Il nostro universo, nel suo funzionamento apparentemente complesso, è regolato da principi fondamentali che determinano come la materia e l’energia interagiscono. Uno di questi regolatori chiave è il primo principio della termodinamica, una legge che svela la relazione intrinseca tra l’energia interna di un sistema e le quantità di calore e lavoro che esso scambia con l’ambiente circostante.
In termini più semplici, il primo principio afferma che l’energia non può essere creata né distrutta, ma solo trasformata. Quando forniamo calore a un sistema (come riscaldare un bollitore), l’energia interna del sistema aumenta. Allo stesso modo, quando un sistema svolge lavoro sull’ambiente (come una turbina che gira), la sua energia interna diminuisce. Questa trasformazione continua di energia è alla base di innumerevoli processi che osserviamo e sperimentiamo ogni giorno.
Ma quali sono le applicazioni pratiche di questo principio? Dalla produzione di energia nei motori delle automobili alla conservazione degli alimenti in un frigorifero, dalla cottura dei cibi in un forno alla generazione di energia in una centrale elettrica, il primo principio della termodinamica è onnipresente.
Scopriamolo insieme!
- Il primo principio della termodinamica: definizione
- Applicazione del primo principio della termodinamica alle trasformazioni isocore
- Applicazione del primo principio della termodinamica alle trasformazioni isobare
- Applicazione del primo principio della termodinamica alle trasformazioni cicliche
- Applicazione del primo principio della termodinamica alle trasformazioni adiabatiche
Il primo principio della termodinamica: definizione

Il primo principio della termodinamica è stato ricavato per via sperimentale nel XIX secolo.
Consideriamo sempre il nostro cilindro contenente gas perfetto e chiuso da un pistone.
Durante l’espansione a pressione costante il sistema costituito dal gas perfetto contenuto nel pistone è passato dallo stato £$A$£, con volume minore, allo stato £$B$£, con volume maggiore e pressione uguale ad £$A$£. Poiché l’energia interna è cambiata da £$U_A$£ a £$U_B$£, c’è stata una variazione di energia interna pari a:
£$\Delta U=U_B -U_A$£
Il sistema, quindi:
- ha guadagnato energia, perché ha assorbito una quantità positiva di calore £$Q$£ dall’ambiente (dal fornello);
- ha perso energia, perché ha compiuto un lavoro £$W$£ positivo, spingendo il pistone verso l’alto.
Poiché l’energia si conserva, la variazione di energia interna deve essere uguale al calore assorbito (energia in ingresso) meno il lavoro compiuto (energia in uscita).
£$\Delta U=Q-W$£
Questo è proprio il primo principio della termodinamica.
È una delle leggi più importanti della fisica, perché ha un ambito di validità universale: si applica infatti a tutti i sistemi termodinamici e non soltanto ai gas perfetti. Inoltre non si applica al solo fenomeno di espansione ma a tutte le trasformazioni termodinamiche, purché si tenga conto del segno delle grandezze £$Q$£ e £$W$£.
In generale, il calore £$Q$£ ha segno positivo quando il sistema acquista energia dall’esterno mediante uno scambio di calore, mentre è negativo quando la cede.
Il lavoro £$W$£, invece, è positivo quando il sistema compie un’espansione e cede energia, mentre è negativo in una compressione, in cui acquisisce energia.
Applicazione del primo principio della termodinamica alle trasformazioni isocore

Alla luce di quanto visto nella scorsa lezione, in cui hai imparato che nelle trasformazioni isocore il lavoro è nullo, è facile intuire come varierà l’espressione del primo principio della termodinamica in questa particolare trasformazione.
Essendo nulla la variazione di volume, il lavoro sarà nullo:
£$W=p\cdot\Delta V=0$£
Andiamo a sostituire all’interno del primo principio della termodinamica e otteniamo:
£$\Delta U=Q$£
Quindi possiamo dire che in una trasformazione isocora la variazione di energia del sistema è uguale alla quantità di calore scambiato.
Applicazione del primo principio della termodinamica alle trasformazioni isobare
Come hai già visto nella lezione precedente, in una trasformazione isobara il lavoro è dato da:
£$W=p\cdot\Delta V$£
Quindi in questo caso il primo principio diventa:
£$\Delta U=Q-p\cdot\Delta V$£
Quindi possiamo dire che in una trasformazione isobara, il calore assorbito durante una trasformazione isobara serve in parte per aumentare la temperatura del sistema e in parte per compiere un lavoro.
Applicazione del primo principio della termodinamica alle trasformazioni cicliche

Una trasformazione ciclica quasistatica può essere realizzata in infiniti modi, purchè abbia la forma di una curva chiusa nel piano pressione-volume.
Alla fine di un ciclo, il sistema termodinamico ritorna nello stesso stato £$A$£ di partenza. Visto che £$U$£ è una funzione di stato, l’energia interna del sistema alla fine del ciclo è uguale a quella che aveva all’inizio, per cui si ha:
£$\Delta U=0$£
Così il primo principio della termodinamica diventa:
£$Q=W$£
Applicazione del primo principio della termodinamica alle trasformazioni adiabatiche
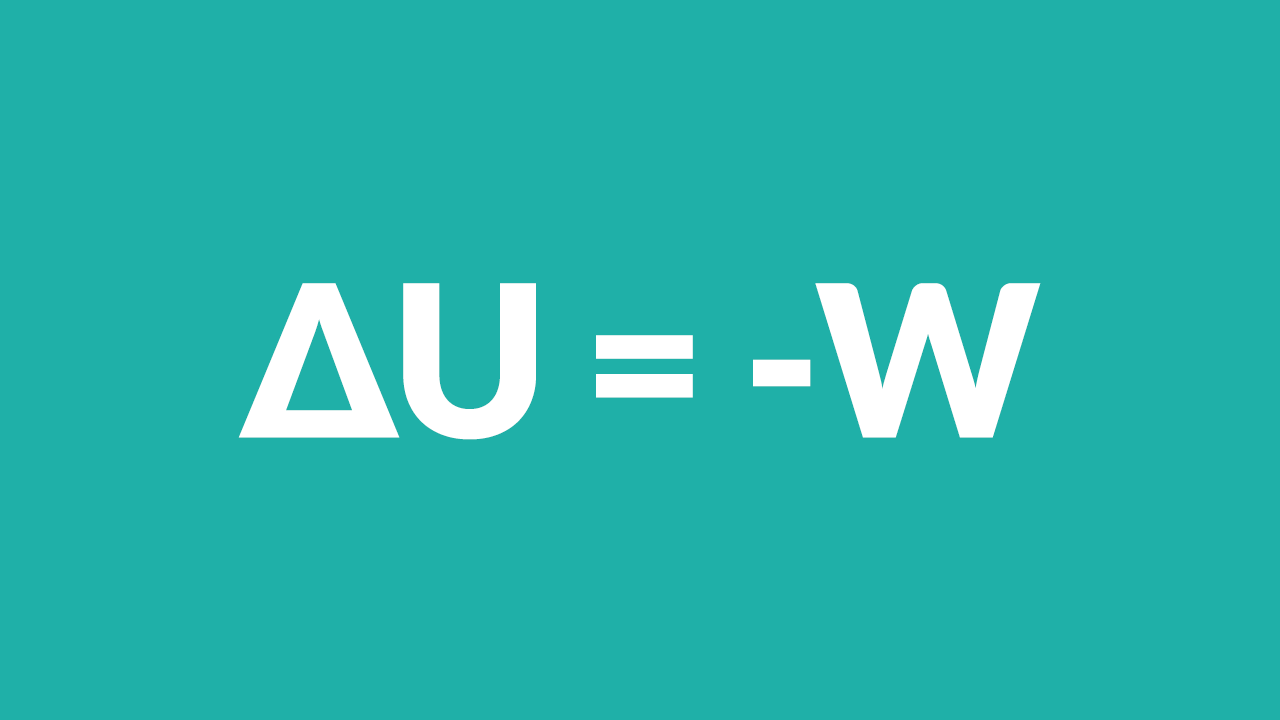
Come abbiamo già visto nella lezione precedente, nelle trasformazioni adiabatiche non c’è scambio di calore, quindi:
£$Q=0$£
Da questo possiamo dedurre che il primo principio della termodinamica diventa:
£$\Delta U=-W$£
Se £$W$£ è positivo, la variazione di energia interna è negativa, e viceversa.
